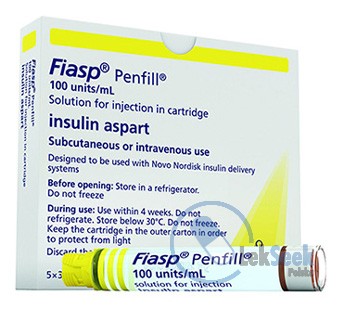
WskazaniaLeczenie cukrzycy u dorosłych, młodzieży i dzieci powyżej 1. rż.DawkowanieProdukt leczniczy jest insuliną doposiłkową podawaną podskórnie do 2 minut przed rozpoczęciem posiłku, z możliwością podania do 20 minut po rozpoczęciu posiłku. Dawkowanie produktu leczniczego jest dostosowywane indywidualnie i ustalane zgodnie z zapotrzebowaniem pacjenta. Produkt leczniczy podawany we wstrzyknięciu podskórnym powinien być stosowany w skojarzeniu z preparatami insuliny o średnim lub długim czasie działania podawanymi przynajmniej raz/dobę. W schemacie leczenia baza-bolus około 50% zapotrzebowania może być pokryte za pomocą produktu leczniczego, a reszta za pomocą preparatów insuliny o średnim lub długim czasie działania. Całkowite dobowe indywidualne zapotrzebowanie na insulinę u dorosłych, młodzieży i dzieci może się różnić i zazwyczaj wynosi 0,5-1,0 jednostki/kg/dobę. Dla osiągnięcia optymalnej kontroli glikemii zalecane jest monitorowanie stężenia glukozy we krwi oraz dostosowywanie dawki insuliny. Dostosowanie dawki produktu leczniczego może być konieczne w przypadku, gdy pacjenci zwiększają aktywność fizyczną, zmieniają dotychczas stosowaną dietę lub podczas równocześnie występujących chorób. Stężenie glukozy we krwi powinno być monitorowane odpowiednio do tych okoliczności. Czas działania może różnić się w zależności od dawki, miejsca wstrzyknięcia, przepływu krwi, temperatury oraz poziomu aktywności fizycznej. Pacjenci leczeni zgodnie ze schematem baza-bolus, którzy zapomnieli o przyjęciu doposiłkowej dawki insuliny, powinni sprawdzić stężenie glukozy we krwi, aby podjąć decyzję, czy potrzebne jest podanie insuliny. Pacjenci powinni powrócić do zwykłego schematu dawkowania podczas następnego posiłku. Siła działania analogów insuliny, w tym produktu leczniczego, wyrażana jest w jednostkach (j.). 1 j. produktu leczniczego odpowiada 1 j.m. insuliny ludzkiej lub 1 j. innego szybkodziałającego analogu insuliny. Podczas zalecania produktu leczniczego należy wziąć pod uwagę jego szybki początek działania. Dawka inicjująca. Pacjenci z cukrzycą typu 1. Zalecana dawka początkowa u nieprzyjmujących wcześniej insuliny pacjentów z cukrzycą typu 1 to około 50% całkowitej dawki dobowej insuliny. Dawka ta powinna zostać podzielona na ilość posiłków na podstawie ich wielkości i składu. Pozostałą częścią całkowitej dawki dobowej insuliny powinna być insulina o średnim lub długim czasie działania. Jako zasadę ogólną należy przyjąć, że do obliczenia początkowej dawki dobowej insuliny u nieprzyjmujących wcześniej insuliny pacjentów z cukrzycą typu 1 powinien być zastosowany przelicznik 0,2-0,4 jednostki insuliny/kg mc. Pacjenci z cukrzycą typu 2. Sugerowana dawka początkowa wynosi 4 jednostki do jednego lub większej liczby posiłków. Liczba wstrzyknięć i wielkość kolejnych dawek zależy od ustalonej indywidualnie glikemii docelowej oraz wielkości i składu posiłków. Dostosowanie dawki może odbywać się codziennie na podstawie stężenia glukozy w osoczu oznaczonego samodzielnie przez pacjenta (ang. SMPG) w poprzedniej(-ich) dobie(-ach). Dawka przyjmowana przed śniadaniem powinna być dostosowana zgodnie z SMPG zmierzonym przed obiadem poprzedniego dnia. Dawka przyjmowana przed obiadem powinna być dostosowana zgodnie z SMPG zmierzonym przed kolacją poprzedniego dnia. Dawka przyjmowana przed kolacją powinna być dostosowana zgodnie z SMPG zmierzonym przed snem poprzedniego dnia. Dostosowanie dawki - szczegóły patrz ChPL. Pacjenci w podeszłym wieku (ł65 lat). Ustalono bezpieczeństwo i skuteczność produktu leczniczego stosowanego u pacjentów w podeszłym wieku, 65-75 lat. Zaleca się ścisłe monitorowanie stężenia glukozy oraz dostosowanie dawki insuliny do indywidualnych potrzeb pacjenta. Doświadczenie związane z leczeniem pacjentów w wieku 75 lat i powyżej jest ograniczone. Zaburzenia czynności nerek i wątroby. Zaburzenia czynności nerek i wątroby mogą zmniejszyć zapotrzebowanie na insulinę u pacjenta. U pacjentów z zaburzeniami czynności nerek lub wątroby zaleca się intensywne monitorowanie stężenia glukozy w osoczu oraz dostosowanie dawki insuliny do indywidualnych potrzeb. Dzieci i młodzież. Produkt leczniczy może być stosowany u młodzieży i dzieci powyżej 1. rż. Brak doświadczenia klinicznego na temat stosowania produktu leczniczego u dzieci poniżej 2 lat. Zaleca się podawanie produktu leczniczego przed posiłkiem (do 2 minut), z możliwością podania do 20 minut po rozpoczęciu posiłku, w przypadku braku pewności co do przyjęcia posiłku. Zmiana stosowanych insulinowych produktów leczniczych. Zalecane jest ścisłe monitorowanie stężenia glukozy podczas zmiany z innych insulin doposiłkowych oraz przez kilka początkowych tyg. leczenia. Zmiana z jednej insuliny doposiłkowej na inną powinna zostać przeprowadzona po przeliczeniu jednostek jeden do jednego. Zmiana typu, rodzaju lub wytwórcy insuliny dotychczas stosowanej przez pacjenta, na produkt leczniczy, musi odbywać się pod ścisłą kontrolą lekarza i może spowodować konieczność zmiany dawkowania. Może zaistnieć konieczność dostosowania dawek i czasu podawania równocześnie stosowanych insulin o średnim lub długim czasie działania lub dostosowania innego towarzyszącego leczenia przeciwcukrzycowego.UwagiProdukt leczniczzy podaje się we wstrzyknięciu podskórnym przez wstrzyknięcie w okolicę brzucha lub ramię. Miejsca wstrzyknięć należy zmieniać w obrębie tego samego obszaru w celu zmniejszenia ryzyka lipodystrofii i amyloidozy skórnej.PrzeciwwskazaniaNadwrażliwość na substancję czynną lub na którąkolwiek substancję pomocniczą.Ostrzeżenia specjalne / Środki ostrożnościW celu poprawienia identyfikowalności biologicznych produktów leczniczych należy czytelnie zapisać nazwę i numer serii podawanego produktu. Pominięcie posiłku lub nieplanowany duży wysiłek fizyczny może prowadzić do hipoglikemii. Hipoglikemia może wystąpić jeśli dawka insuliny jest zbyt duża w stosunku do zapotrzebowania na insulinę. Pacjenci, u których kontrola stężenia glukozy we krwi znacznie poprawiła się, np. w wyniku intensywnej insulinoterapii, powinni zostać poinformowani, że typowe dla nich objawy zapowiadające hipoglikemię mogły ulec zmianie. U pacjentów długo chorujących na cukrzycę objawy zapowiadające hipoglikemię mogą nie występować. Czas do wystąpienia hipoglikemii zwykle jest odzwierciedleniem profilu czasu działania stosowanego preparatu insuliny. W porównaniu z innymi rodzajami insuliny doposiłkowej hipoglikemia po wstrzyknięciu/wlewie produktu leczniczego może wystąpić wcześniej ze względu na jego wcześniejszy początek działani. Ponieważ produkt leczniczy powinien być podawany do 2 minut przed rozpoczęciem posiłku, z możliwością podania do 20 minut po rozpoczęciu posiłku, należy brać pod uwagę czas do wystąpienia działania, gdy produkt jest zalecany pacjentom, u których współistniejące choroby lub przyjmowane leki mogą mieć wpływ na spowolnienie wchłaniania pokarmu. Dzieci i młodzież: w celu uniknięcia nocnej hipoglikemii, zaleca się ścisłe monitorowanie stężenia glukozy w przypadku podania tego produktu leczniczego po rozpoczęciu ostatniego posiłku w danym dniu. Stosowanie nieodpowiednich dawek lub przerwanie leczenia, szczególnie u pacjentów wymagających podawania insuliny, może prowadzić do hiperglikemii i cukrzycowej kwasicy ketonowej - stanów, które mogą prowadzić do zgonu. Ciągły podskórny wlew insuliny (CSII): nieprawidłowe działanie pompy lub zestawu do wlewu może prowadzić do szybkiego wystąpienia hiperglikemii i kwasicy ketonowej. Konieczne jest niezwłoczne rozpoznanie i usunięcie przyczyny hiperglikemii lub kwasicy ketonowej. Może być wymagane tymczasowe leczenie za pomocą wstrzyknięć podskórnych. Wkład (PumpCart) należy stosować wyłącznie z przeznaczoną do tego wkładu pompą insulinową. Produktu nie wolno stosować z innymi urządzeniami nieprzeznaczonymi do używania z tym wkładem, gdyż może to spowodować niedokładne dawkowanie insuliny, a w konsekwencji prowadzić do hiper- lub hipoglikemii. Pacjentów należy poinformować o konieczności ciągłego zmieniania miejsca wstrzyknięcia, w celu zmniejszenia ryzyka lipodystrofii i amyloidozy skórnej. Po wstrzyknięciu insuliny w obszarze występowania takich odczynów, może być opóźnione wchłanianie insuliny i pogorszona możliwość kontroli glikemii. Zgłaszano, że nagła zmiana miejsca wstrzyknięcia na obszar niedotknięty zmianami skutkuje wystąpieniem hipoglikemii. Po zmianie miejsca wstrzyknięcia z obszaru występowania takich odczynów na obszar niedotknięty zmianami, zaleca się kontrolę stężenia glukozy we krwi; można też rozważyć dostosowanie dawki leków przeciwcukrzycowych. Zmiana typu lub rodzaju insuliny powinna odbywać się pod ścisłą kontrolą lekarza. Zmiana stężenia insuliny, rodzaju (wytwórcy), typu, pochodzenia (insulina zwierzęca, ludzka lub analog insuliny ludzkiej) i/lub metody wytwarzania (rekombinacja DNA lub insulina pochodzenia zwierzęcego) mogą spowodować potrzebę zmiany dawki. Pacjenci zmieniający leczenie z innej insuliny na produkt leczniczy mogą wymagać innej dawki niż dawka dotychczas stosowanych insulinowych produktów leczniczych. Współistniejące choroby, zwłaszcza zakażenia i stany gorączkowe, zwykle zwiększają zapotrzebowanie pacjenta na insulinę. Współistniejące choroby nerek, wątroby lub choroby mające wpływ na nadnercza, przysadkę mózgową lub tarczycę mogą powodować konieczność zmiany dawki insuliny. Zgłaszano przypadki zastoinowej niewydolności serca związane z leczeniem pioglitazonem w skojarzeniu z insuliną, w szczególności u pacjentów obciążonych czynnikami ryzyka rozwoju zastoinowej niewydolności serca. Należy brać to pod uwagę w przypadku rozważania leczenia skojarzonego pioglitazonem i insulinowymi produktami leczniczymi. Jeśli stosuje się leczenie skojarzone, należy obserwować, czy u pacjentów pojawiają się przedmiotowe i podmiotowe objawy zastoinowej niewydolności serca, przyrost mc. i obrzęki. Należy zaprzestać stosowania pioglitazonu w przypadku nasilenia się kardiologicznych objawów niepożądanych. Intensyfikacja lub szybka poprawa kontroli stężenia glukozy wiąże się z przemijającym, odwracalnym zaburzeniem refrakcji oka, nasileniem się objawów retinopatii cukrzycowej, ostrą bolesną neuropatią obwodową i obrzękami obwodowymi. Jednak długotrwała kontrola glikemii zmniejsza ryzyko retinopatii cukrzycowej i neuropatii. Podawanie insuliny może spowodować powstanie przeciwciał skierowanych przeciwko insulinie. W rzadkich przypadkach obecność takich przeciwciał może wymagać dostosowania dawki insuliny w celu zmniejszenia skłonności do występowania hiperglikemii lub hipoglikemii. Pacjenci muszą zostać poinstruowani, że zawsze przed każdym wstrzyknięciem muszą sprawdzić etykietę w celu uniknięcia przypadkowego podania innej insuliny. Przed podaniem pacjenci muszą również sprawdzić ilość jednostek w dawce. Aby pacjenci mogli samodzielnie podawać lek, muszą być w stanie odczytać skalę dawkowania. Pacjenci niewidomi lub niedowidzący muszą zostać poinformowani o konieczności uzyskania pomocy osoby dobrze widzącej, przeszkolonej w zakresie podawania insuliny. Przed podróżą między różnymi strefami czasowymi pacjent powinien zasięgnąć porady lekarza. Ten produkt leczniczy zawiera mniej niż 1 mmol sodu (23 mg) na dawkę, to znaczy lek uznaje się za „wolny od sodu”. W przypadku wystąpienia hipoglikemii może dojść do zaburzenia koncentracji i wydłużenia czasu reakcji pacjenta. Może to stwarzać zagrożenie w sytuacjach, kiedy zdolności te są szczególnie ważne (np. podczas prowadzenia pojazdów lub obsługiwania maszyn). Należy zalecić pacjentom podjęcie środków ostrożności w celu uniknięcia hipoglikemii podczas prowadzenia pojazdów. Jest to szczególnie ważne u tych pacjentów, u których objawy zapowiadające hipoglikemię są słabo nasilone albo nie występują lub u których hipoglikemia występuje często. W takich przypadkach należy rozważyć, czy możliwe jest prowadzenie pojazdów. Na podstawie wyników badań klinicznych z zastosowaniem insuliny aspart stwierdzono, że częstość, rodzaj i nasilenie działań niepożądanych zaobserwowanych u pacjentów w podeszłym wieku i u pacjentów z zaburzeniami czynności nerek lub wątroby nie wykazują żadnych różnic w stosunku do szerokiego doświadczenia klinicznego dotyczącego populacji ogólnej. Profil bezpieczeństwa u pacjentów w bardzo podeszłym wieku (ł75 lat) lub pacjentów z umiarkowanymi do ciężkich zaburzeniami czynności nerek lub wątroby jest ograniczony. Produkt leczniczy podawano pacjentom w podeszłym wieku w celu badania właściwości farmakokinetycznych.InterakcjeWiele produktów leczniczych ma wpływ na metabolizm glukozy. Zapotrzebowanie na insulinę mogą zmniejszać następujące substancje: doustne leki przeciwcukrzycowe, inhibitory MAO, leki blokujące receptory b-adrenergiczne, inhibitory ACEI, salicylany, steroidy anaboliczne, sulfonamidy i agoniści receptora GLP-1. Zapotrzebowanie na insulinę mogą zwiększać następujące substancje: doustne środki antykoncepcyjne, leki tiazydowe, glikokortykosteroidy, hormony tarczycy, leki sympatykomimetyczne, hormon wzrostu i danazol. Leki blokujące receptory b-adrenergiczne mogą maskować objawy hipoglikemii. Oktreotyd i lanreotyd mogą zarówno zwiększać, jak i zmniejszać zapotrzebowanie na insulinę. Alkohol może nasilać lub zmniejszać hipoglikemizujące działanie insuliny.Ciąża i laktacjaProdukt leczniczy może być stosowany w okresie ciąży. Dane z dwóch randomizowanych, kontrolowanych badań klinicznych przeprowadzonych z użyciem insuliny aspart (322 + 27 kobiet w ciąży) nie wskazują żadnego niepożądanego wpływu insuliny aspart na ciążę ani na zdrowie płodu/noworodka w porównaniu z rozpuszczalną insuliną ludzką. W okresie ciąży lub jej planowania u pacjentek z cukrzycą (typu 1, typu 2 lub cukrzycą ciążową) zalecana jest intensywna kontrola i monitorowanie stężenia glukozy we krwi. Zapotrzebowanie na insulinę zwykle zmniejsza się w I trymestrze ciąży, a następnie zwiększa się w czasie trymestru II i III. Po porodzie zapotrzebowanie na insulinę zazwyczaj gwałtownie wraca do poziomu sprzed okresu ciąży. Brak ograniczeń dotyczących stosowania produktu leczniczego podczas karmienia piersią. Stosowanie insuliny przez karmiącą matkę nie stanowi zagrożenia dla dziecka. Może jednak zaistnieć konieczność dostosowania dawki. Badania na zwierzętach dotyczące wpływu na reprodukcję nie wykazały żadnych różnic między insuliną aspart a insuliną ludzką pod względem wpływu na płodność.Działania niepożądaneNajczęściej obserwowanym w trakcie leczenia działaniem niepożądanym jest hipoglikemia. Zaburzenia układu immunologicznego: (niezbyt często) nadwrażliwość; (nieznana) reakcja anafilaktyczna. Zaburzenia metabolizmu i odżywiania: (bardzo często) hipoglikemia. Zaburzenia skóry i tkanki podskórnej: (często) objawy alergii skórnej; (niezbyt często) lipodystrofia; (nieznana) amyloidoza skórna (na podstawie informacji uzyskanych po wprowadzeniu produktu do obrotu). Zaburzenia ogólne i stany w miejscu podania: (często) reakcje w miejscu wstrzyk./wlewu. Objawy alergii skórnej zgłaszane po zastosowaniu produktu leczniczego (1,8% w porównaniu z 1,5% w przypadku leku porównawczego) obejmowały wyprysk, wysypkę, wysypkę ze świądem, pokrzywkę i zapalenie skóry. W przypadku produktu leczniczego uogólnione reakcje nadwrażliwości (objawiające się uogólnioną skórną wysypką i obrzękiem twarzy) zgłaszano niezbyt często (0,2% w porównaniu z 0,3% w przypadku leku porównawczego). Hipoglikemia może wystąpić, gdy dawka insuliny jest zbyt duża w stosunku do zapotrzebowania. Ciężka hipoglikemia może prowadzić do utraty przytomności i/lub drgawek, a w następstwie do przemijającego lub trwałego upośledzenia czynności mózgu, a nawet do śmierci. Objawy hipoglikemii zwykle pojawiają się nagle. Mogą to być: zimne poty, chłodna blada skóra, zmęczenie, pobudzenie nerwowe lub drżenie, niepokój, nienaturalne uczucie zmęczenia lub osłabienia, stan splątania, zaburzenia koncentracji, senność, uczucie silnego głodu, zaburzenia widzenia, ból głowy, nudności i kołatanie serca. W porównaniu z innymi rodzajami insuliny doposiłkowej, hipoglikemia po wstrzyknięciu/wlewie produktu leczniczego może wystąpić wcześniej ze względu na szybszy początek działania. Lipodystrofia (włączając lipohipertrofię, lipoatrofię) i amyloidoza skórna mogą wystąpić w miejscu wstrzyknięcia i spowodować miejscowe opóźnienie wchłaniania insuliny. U pacjentów leczonych produktem leczniczym zgłaszano (0,5% w porównaniu z 0,2% w przypadku leku porównawczego) lipodystrofię w miejscu wstrzyknięcia/wlewu. Ciągła zmiana miejsca wstrzyknięcia w obrębie danego obszaru może zmniejszyć ryzyko wystąpienia takich reakcji lub im zapobiec. U pacjentów leczonych produktem leczniczym zgłaszano (1,3% w porównaniu z 1,0% w przypadku leku porównawczego) reakcje w miejscu wstrzyknięcia (w tym wysypkę, zaczerwienienie, stan zapalny, ból i zasinienie). U pacjentów stosujących produkt leczniczy w ciągłym podskórnym wlewie insuliny (CSII) (N=261) zgłaszano (10,0% w porównaniu z 8,3% w przypadku leku porównawczego) reakcje w miejscu wlewu (w tym zaczerwienienie, stan zapalny, podrażnienie, ból, zasinienie i swędzenie). Reakcje te są zwykle łagodne i przemijające oraz zazwyczaj ustępują w czasie trwania leczenia. Dzieci i młodzież: bezpieczeństwo i skuteczność potwierdzono w badaniu prowadzonym z udziałem dzieci z cukrzycą typu 1 w wieku 2-18 lat. Badanie obejmowało 519 pacjentów leczonych produktem leczniczym. W ogólnym podsumowaniu częstość, rodzaj i ciężkość działań niepożądanych u dzieci i młodzieży nie wskazują na różnice w porównaniu z doświadczeniem dotyczącym pacjentów dorosłych. W wymienionym badaniu z udziałem dzieci i młodzieży, lipodystrofia (w tym lipohipertrofia, lipoatrofia) w miejscu wstrzyknięcia była zgłaszana częściej w porównaniu z badaniami z udziałem dorosłych (patrz powyżej). Wśród dzieci i młodzieży lipodystrofia była zgłaszana z częstością 2,1% w przypadku produktu leczniczego Fiasp w porównaniu z 1,6% w przypadku produktu NovoRapid.PrzedawkowanieNie można dokładnie określić dawki powodującej przedawkowanie insuliny, a hipoglikemia może rozwijać się stopniowo, jeśli podano zbyt dużą dawkę w stosunku do zapotrzebowania pacjenta: łagodna hipoglikemia może być leczona doustnym podaniem glukozy lub produktów zawierających cukier. Zaleca się, aby pacjenci z cukrzycą zawsze mieli przy sobie produkty zawierające cukier. Ciężka hipoglikemia, kiedy pacjent traci przytomność, może być leczona glukagonem (w dawce 0,5-1 mg) podanym domięśniowo lub podskórnie przez osobę przeszkoloną lub glukozą podaną dożylnie przez osobę należącą do fachowego personelu medycznego. Glukozę należy podać dożylnie w przypadku, gdy stan pacjenta nie poprawia się w ciągu 10-15 min. po podaniu glukagonu. Po odzyskaniu przytomności zalecane jest doustne podanie pacjentowi węglowodanów w celu zapobiegania nawrotowi hipoglikemii.DziałanieProdukt leczniczy jest szybkodziałającą formą insuliny aspart. Podstawowym działaniem produktu leczniczego jest regulowanie metabolizmu glukozy. Insuliny, w tym insulina aspart, substancja czynna produktu leczniczego, wywierają swoje swoiste działanie przez wiązanie się z receptorami insulinowymi. Insulina związana z receptorem obniża stężenie glukozy we krwi przez ułatwienie wychwytu glukozy przez komórki mięśni szkieletowych i tkanki tłuszczowej oraz przez hamowanie uwalniania glukozy z wątroby. Insulina hamuje lipolizę w adipocytach, hamuje proteolizę i wzmaga syntezę białek.Skład1 ml roztw. zawiera 100 j. insuliny aspart (co odpowiada 3,5 mg). 1 wkład zawiera 300 j. insuliny aspart w 3 ml roztw. 1 fiol. zawiera 1000 j. insuliny aspart w 10 ml roztw.









 Alkohol
Alkohol Ciąża - trymestr 1 - Kategoria A
Ciąża - trymestr 1 - Kategoria A Ciąża - trymestr 2 - Kategoria A
Ciąża - trymestr 2 - Kategoria A Ciąża - trymestr 3 - Kategoria A
Ciąża - trymestr 3 - Kategoria A Wykaz B
Wykaz B Produkt leczniczy podlega dodatkowemu monitorowaniu
Produkt leczniczy podlega dodatkowemu monitorowaniu Papierosy
Papierosy



Komentarze
[ z 0]